Ma trận và Đề KSCL giữa học kì I môn Hóa Học 9 - Phòng GD&ĐT Sa Pa - Trường PTDTBT THCS Suối Thầu (Năm học 2017-2018)(Có đáp án)
Bạn đang xem tài liệu "Ma trận và Đề KSCL giữa học kì I môn Hóa Học 9 - Phòng GD&ĐT Sa Pa - Trường PTDTBT THCS Suối Thầu (Năm học 2017-2018)(Có đáp án)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Ma trận và Đề KSCL giữa học kì I môn Hóa Học 9 - Phòng GD&ĐT Sa Pa - Trường PTDTBT THCS Suối Thầu (Năm học 2017-2018)(Có đáp án)
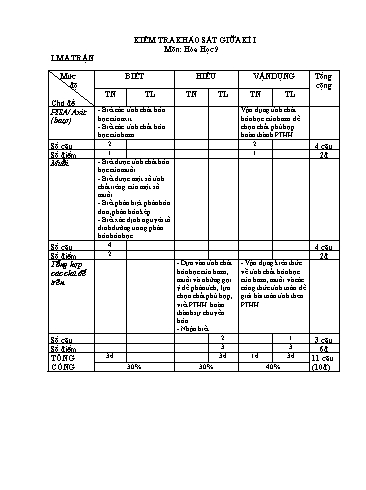
KIỂM TRA KHẢO SÁT GIỮA KÌ I Môn: Hóa Học 9 I.MA TRẬN Mức BIẾT HIỂU VẬN DỤNG Tổng độ cộng TN TL TN TL TN TL Chủ đề PISA/ Axit - Biết các tính chất hóa Vận dụng tính chất (bazơ) học của axit. hóa học của bazơ để - Biết các tính chất hóa chọn chất phù hợp học của bazơ hoàn thành PTHH Số câu 2 2 4 câu Số điểm 1 1 2đ Muối - Biết được tính chất hóa học của muối. - Biết được một số tính chất riêng của một số muối. - Biết phân biệt phân bón đơn, phân bón kép. - Biết xác định nguyên tố dinh dưỡng trong phân bón hóa học. Số câu 4 4 câu Số điểm 2 2đ Tổng hợp - Dựa vào tính chất - Vận dụng kiến thức các chủ đề hóa học của bazơ, về tính chất hóa học trên muối và những gợi của bazơ, muối và các ý để phân tích, lựa công thức tính toán để chọn chất phù hợp, giải bài toán tính theo viết PTHH hoàn PTHH. thành sự chuyển hóa. - Nhận biết Số câu 2 1 3 câu Số điểm 3 3 6đ TỔNG 3đ 3đ 1đ 3đ 11 câu CỘNG 30% 30% 40% (10đ) TRƯỜNG PTDTBT THCS ĐỀ KHẢO SÁT GIỮA HỌC KÌ I SUỐI THẦU Năm học: 2017 -2018 Đề số 01 MÔN: HÓA HỌC 9 (Đề gồm 7 câu, 01 trang) Thời gian: 45 phút (Không kể thời gian giao đề) I. PISA/AXIT Axit (bắt nguồn từ tiếng Pháp: acide) là các hợp chất hóa học có thể hòa tan trong nước và có vị chua, thông thường biểu diễn dưới dạng công thức tổng quát HxAy.Từ "acide" trong tiếng Pháp bắt nguồn từ từ tiếng Latin acidus/acēre, có nghĩa là chua. Thông thường, axit là bất kỳ chất nào tạo được dung dịch có độ pH nhỏ hơn 7 khi nó hòa tan trong nước. Độ pH càng nhỏ thì tính axit càng mạnh. Các chất có đặc tính giống axit được gọi là có tính axit. Câu hỏi: Dựa vào đoạn thông tin trên em hãy cho biết những tính chất hóa học của axit?(2 diểm) II.TRẮC NGHIỆM(2đ) Câu 1: Natri hiđroxit làm quỳ tím ẩm chuyển sang màu A. đỏ B. xanh C. hồng D. không chuyển màu Câu 2: Dãy chất gồm toàn các bazơ bị nhiệt phân tạo ra oxit là A. NaOH, Ba(OH)2, KOH. C. Fe(OH)3, Zn(OH)2, KOH. B. Cu(OH)2, Fe(OH)3, Al(OH)3. D. Ca(OH)2, NaOH , Cu(OH)2. Câu 3: Dãy chất nào sau đây toàn là muối: A. NaOH ; HCl ; CuSO4 B. CaCO 3 ; NaHCO3 ; HCl C. NaNO3 ; CuSO4 ; Ca(NO3)2 D. K 2SO4 ; H2SO4 ; FeCl3 Câu 4: Muối có nhiều trong nước biển là A. NaCl B. MgCl2 C. CaSO4 D. KNO3 III.TỰ LUẬN(6đ): Câu 1(2đ). Viết PTHH thực hiện sự chuyển hoá sau: (1) (2) (3) (4) CuO-- CuCl2-- Cu(OH)2-- CuO -- CuSO4 Câu 2(1đ). Có 2 lọ mất nhãn đựng các dung dịch sau: CuSO 4 và Na2SO4. Hãy trình bày phương pháp hóa học để nhận biết hai chất trên. Viết PTHH (nếu có). Câu 3(3đ).Cho 500ml dung dịch MgCl2 tác dụng vừa đủ với 30g NaOH. a) Viết PTPƯ xảy ra. b) Tính khối lượng kết tủa. c) Tính nồng độ Mol dung dịch MgCl2 đã dùng. (Na = 23, Mg = 24 , O = 16, H = 1, Cl = 35,5 ). HƯỚNG DẪN CHẤM I. PISA/AXIT + Làm đổi màu quỳ tím sang màu đỏ 0.5đ + Tác dụng với kim loại tạo muối và H2 0.5đ + Tác dụng với Bazo tạo muối và H2O 0.5đ + Tác dụng với Oxit bazo tạo muối và H2O 0.5đ II.TRẮC NGHIỆM(2đ) :Mỗi câu đúng 0,5đ Câu 1 B Câu 2 B Câu 3 C Câu 4 A III.TỰ LUẬN(6đ): Câu 1(2đ)-Mỗi PTHH đúng 0,5đ (1): CuO + 2HCl CuCl2 + H2O (2): CuCl2 + 2NaOH Cu(OH)2 + 2NaCl t0 (3): Cu(OH)2 CuO + H2O (4): CuO + H2SO4 CuSO4 + H2O Câu 2(1đ): - Dùng NaOH nhận biết CuSO4 ( có kết tủa xanh) (0,25đ) PTHH: CuSO4 + 2NaOH Cu(OH)2 + Na2SO4 (0,5 đ) - Chất còn lại là Na2SO4 (0,25 đ) C©u 3 (3 ®) a) MgCl2 + 2NaOH 2NaCl + Mg(OH)2 (1) 0,5đ 0,375 mol 0,75 mol 0,375 mol t0 Mg(OH)2 MgO + H2O (2) 0,5đ 0,375 mol 0,375 mol b) Theo đề ta có: số mol của NaOH = 30: 40 = 0,75 mol (TVPƯ 1) 0,25đ Số mol Mg(OH)2 = 0,375 mol (TVPƯ 2) 0,5đ Số mol MgO = 0,375 mol 0,5đ Khối lượng MgO = 0,375.40 = 15g 0,25đ c) Theo phản ứng 1: số mol MgCl2 = 0,375 mol 0,25đ Nồng độ Mol dd MgCl2 = 0,375 : 0,5 = 0,75 M 0,25đ TRƯỜNG PTDTBT THCS ĐỀ KHẢO SÁT GIỮA HỌC KÌ I SUỐI THẦU Năm học: 2017 -2018 Đề số 02 MÔN: HÓA HỌC 9 (Đề gồm 7 câu, 01 trang) Thời gian: 45 phút (Không kể thời gian giao đề) I. PISA/BAZƠ Bazơ có công thức hoá học chung là B(OH)x. Một định nghĩa phổ biến của bazơ (còn được viết là base) theo Svante Arrhenius là một hợp chất hóa học hoặc là cung cấp các ion hiđrôxít hoặc là hấp thụ các ion hiđrô khi hòa tan trong nước. Các bazơ và các axít được nói đến như là các chất ngược nhau vì hiệu + ứng của axít là tăng nồng độ ion hydroni (H3O ) trong nước, còn bazơ thì làm giảm nồng độ của ion này. Các bazơ theo Arrhenius là những chất hòa tan trong nước và có pH lớn hơn 7 khi ở trong dung dịch.Bazơ là hợp chất mà phân tử có một nguyên tử kim loại liên kết với một hay nhiều nhóm hidroxit (-OH) Câu hỏi: Dựa vào đoạn thông tin trên em hãy cho biết những tính chất hóa học của bazơ?(2 diểm) II. TRẮC NGHIỆM(2đ) Câu 1: Canxi hiđroxit làm quỳ tím ẩm chuyển sang màu A. đỏ B. xanh C. hồng D. không chuyển màu Câu 2: Dãy chất gồm toàn các bazơ bị nhiệt phân tạo ra oxit là A. NaOH, Ba(OH)2, KOH. B. Fe(OH)3, Zn(OH)2, KOH. C. Cu(OH)2, Fe(OH)3, Al(OH)3. D.Ca(OH)2, NaOH , Cu(OH)2. Câu 3: Dãy chất nào sau đây toàn là muối: A. NaCl ; HCl ; CuSO4 B. CaCO 3 ; NaHCO3 ; HCl C. AgNO3 ; PbSO4 ; Mg(NO3)2 D. K 2SO4 ; H2SO4 ; FeCl3 Câu 4: Muối có nhiều trong nước biển là A. NaCl B. MgCl2 C. CaSO4 D. KNO3 III. TỰ LUẬN(6đ): Câu 1(2đ). Viết PTHH thực hiện sự chuyển hoá sau: (1) (2) (3) (4) Al2O3-- AlCl3-- Al(OH)3-- Al2O3 -- Al2(SO4)3 Câu 2(1đ). Có 2 lọ mất nhãn đựng các dung dịch sau: CuSO 4 và Na2SO4. Hãy trình bày phương pháp hóa học để nhận biết hai chất trên. Viết PTHH (nếu có). Câu 3(3đ).Cho 500ml dung dịch MgCl2 tác dụng vừa đủ với 30g NaOH. a) Viết PTPƯ xảy ra. d) Tính khối lượng kết tủa. e) Tính nồng độ Mol dung dịch MgCl2 đã dùng. (Na = 23, Mg = 24 , O = 16, H = 1, Cl = 35,5 ). HƯỚNG DẪN CHẤM I. PISA/BAZƠ + Làm đổi màu quỳ tím sang màu xanh 0.5đ + Nhiệt phân bazo không tan tạo oxit và H2O 0.5đ + Tác dụng với axit tạo muối và H2O 0.5đ + Tác dụng với Oxit axit tạo muối và H2O 0.5đ II.TRẮC NGHIỆM(2đ) :Mỗi câu đúng 0,5đ Câu 1 B Câu 2 C Câu 3 C Câu 4 A III.TỰ LUẬN(6đ): Câu 1(2đ)-Mỗi PTHH đúng 0,5đ (1): Al2O3 + 2HCl 2AlCl3 +3 H2O (2): AlCl3 + 3NaOH Al(OH)3 + 3NaCl t0 (3): 2Al(OH)3 Al2O3 + 3H2O (4): Al2O3 + 3H2SO4 Al2(SO4)3 + 3H2O Câu 2(1đ): - Dùng NaOH nhận biết CuSO4 ( có kết tủa xanh) (0,25đ) PTHH: CuSO4 + 2NaOH Cu(OH)2 + Na2SO4 (0,5 đ) - Chất còn lại là Na2SO4 (0,25 đ) C©u 3 (3 ®) a) MgCl2 + 2NaOH 2NaCl + Mg(OH)2 (1) 0,5đ 0,375 mol 0,75 mol 0,375 mol t0 Mg(OH)2 MgO + H2O (2) 0,5đ 0,375 mol 0,375 mol b) Theo đề ta có: số mol của NaOH = 30: 40 = 0,75 mol (TVPƯ 1) 0,25đ Số mol Mg(OH)2 = 0,375 mol (TVPƯ 2) 0,5đ Số mol MgO = 0,375 mol 0,5đ Khối lượng MgO = 0,375.40 = 15g 0,25đ c) Theo phản ứng 1: số mol MgCl2 = 0,375 mol 0,25đ Nồng độ Mol dd MgCl2 = 0,375 : 0,5 = 0,75 M 0,25đ TRƯỜNG PTDTBT THCS ĐỀ KHẢO SÁT GIỮA HỌC KÌ I SUỐI THẦU Năm học: 2017 -2018 Đề số 03 MÔN: HÓA HỌC 9 (Đề gồm 8 câu, 01 trang) Thời gian: 45 phút (Không kể thời gian giao đề) I. PISA/AXIT Axit (bắt nguồn từ tiếng Pháp: acide) là các hợp chất hóa học có thể hòa tan trong nước và có vị chua, thông thường biểu diễn dưới dạng công thức tổng quát HxAy.Từ "acide" trong tiếng Pháp bắt nguồn từ từ tiếng Latin acidus/acēre, có nghĩa là chua. Thông thường, axit là bất kỳ chất nào tạo được dung dịch có độ pH nhỏ hơn 7 khi nó hòa tan trong nước. Độ pH càng nhỏ thì tính axit càng mạnh. Các chất có đặc tính giống axit được gọi là có tính axit. Câu hỏi: Dựa vào đoạn thông tin trên em hãy cho biết những tính chất hóa học của axit?(2 diểm) II. TRẮC NGHIỆM(2đ) Câu 1: Đồng hiđroxit làm quỳ tím ẩm chuyển sang màu A. đỏ B. xanh C. hồng D. không chuyển màu Câu 2: Dãy chất gồm toàn các bazơ bị nhiệt phân tạo ra oxit là A. NaOH, Ba(OH)2, KOH. B. Fe(OH)3, Zn(OH)2, KOH. C. Cu(OH)2, Fe(OH)3, Al(OH)3. D. Ca(OH)2, NaOH , Cu(OH)2. Câu 3: Dãy chất nào sau đây toàn là muối: A. NaCl ; HCl ; CuSO4 B. CaCO 3 ; NaHCO3 ; HCl C. AgNO3 ; PbSO4 ; Mg(NO3)2 D. K 2SO4 ; H2SO4 ; FeCl3 Câu 4: Muối có nhiều trong nước biển là A. NaCl B. MgCl2 C. CaSO4 D. KNO3 III. TỰ LUẬN(6đ): Câu 1(2đ). Viết PTHH thực hiện sự chuyển hoá sau: (1) (2) (3) (4) FeO-- FeCl2-- Fe(OH)2-- FeO -- FeSO4 Câu 2(1đ). Có 2 lọ mất nhãn đựng các dung dịch sau: CuSO 4 và Na2SO4. Hãy trình bày phương pháp hóa học để nhận biết hai chất trên. Viết PTHH (nếu có). Câu 3(3đ).Cho 500ml dung dịch MgCl2 tác dụng vừa đủ với 30g NaOH. a) Viết PTPƯ xảy ra. f) Tính khối lượng kết tủa. g) Tính nồng độ Mol dung dịch MgCl2 đã dùng. (Na = 23, Mg = 24 , O = 16, H = 1, Cl = 35,5 ). HƯỚNG DẪN CHẤM I. PISA/AXIT + Làm đổi màu quỳ tím sang màu đỏ 0.5đ + Tác dụng với kim loại tạo muối và H2 0.5đ + Tác dụng với Bazo tạo muối và H2O 0.5đ + Tác dụng với Oxit bazo tạo muối và H2O 0.5đ II.TRẮC NGHIỆM(2đ) :Mỗi câu đúng 0,5đ Câu 1 B Câu 2 C Câu 3 C Câu 4 A III.TỰ LUẬN(6đ): Câu 1(2đ)-Mỗi PTHH đúng 0,5đ (1): FeO + 2HCl FeCl2 + H2O (2): FeCl2 + 2NaOH Fe(OH)2 + 2NaCl t0 (3): Fe(OH)2 FeO + H2O (4): FeO + H2SO4 FeSO4 + H2O Câu 2(1đ): - Dùng NaOH nhận biết CuSO4 ( có kết tủa xanh) (0,25đ) PTHH: CuSO4 + 2NaOH Cu(OH)2 + Na2SO4 (0,5 đ) - Chất còn lại là Na2SO4 (0,25 đ) C©u 3 (3 ®) a) MgCl2 + 2NaOH 2NaCl + Mg(OH)2 (1) 0,5đ 0,375 mol 0,75 mol 0,375 mol t0 Mg(OH)2 MgO + H2O (2) 0,5đ 0,375 mol 0,375 mol b) Theo đề ta có: số mol của NaOH = 30: 40 = 0,75 mol (TVPƯ 1) 0,25đ Số mol Mg(OH)2 = 0,375 mol (TVPƯ 2) 0,5đ Số mol MgO = 0,375 mol 0,5đ Khối lượng MgO = 0,375.40 = 15g 0,25đ c) Theo phản ứng 1: số mol MgCl2 = 0,375 mol 0,25đ Nồng độ Mol dd MgCl2 = 0,375 : 0,5 = 0,75 M 0,25đ
File đính kèm:
 ma_tran_va_de_kscl_giua_hoc_ki_i_mon_hoa_hoc_9_phong_gddt_sa.doc
ma_tran_va_de_kscl_giua_hoc_ki_i_mon_hoa_hoc_9_phong_gddt_sa.doc