Giáo án Hóa học Lớp 9 - Học kì II - Bài 56: Ôn tập cuối năm - Năm học 2017-2018 - Nguyễn Đình Quyết
Bạn đang xem tài liệu "Giáo án Hóa học Lớp 9 - Học kì II - Bài 56: Ôn tập cuối năm - Năm học 2017-2018 - Nguyễn Đình Quyết", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Giáo án Hóa học Lớp 9 - Học kì II - Bài 56: Ôn tập cuối năm - Năm học 2017-2018 - Nguyễn Đình Quyết
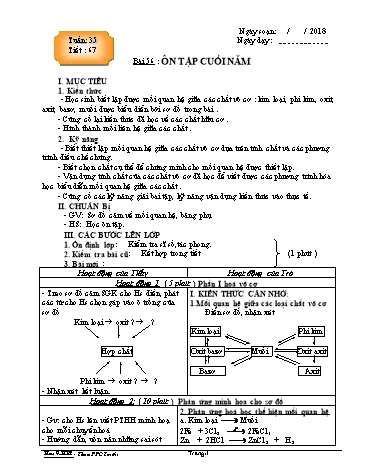
của HS nếu có. b. Phi kim Muối t0 S + 2Na Na2S c. Kim loại Oxit bazơ - Gv: nhận xét Ca + O2 2CaO d. Phi kim Oxit axit t0 4P + 5O2 2P2O5 e. Oxit bazơ Muối CuO + 2HCl CuCl2 + H2 g. Oxit axit Muối CO2 +2NaOH Na2CO3 + H2O Hoạt động 2: ( 25 phút ) Giải bài tập Gv: Cho Hs làm bài tập 1, 2, 3 II. BÀI TẬP Gv: ghi đề bài tập lên hướng dẫn và Hs: Thảo luận làm bài tập 10 phút sau đó cho Hs thảo luận làm bài vào giấy treo bảng phụ lên cho từng nhóm nhận xét. nháp ( Ghi vào bảng phụ ) 1. a. Lấy mỗi chất một ít cho tác dụng với kim loại Zn chất nào có xuất hiện bọt khí là H2SO4 , chất không có hiện tượng là Na2SO4. Zn + H2SO4 ZnSO4 + H2 b. Lấy mỗi chất một ít cho tác dụng với đinh sắt chất có khí thoát ra là HCl, chất không có hiện tượng là FeCl2. Fe + 2HCl FeCl2 + H2 c. Lấy mỗi chất một ít cho phản ứng với H2SO4 loãng dư,chất có bọt khí bay ra và tan hết đó là Na2CO3 . Chất có bọt khí bay ra, đồng thời có kết tủa tạo thành là CaCO3. Na2CO3 + H2SO4 Na2SO4 + H2O + CO2 CaCO3 + H2SO4 CaSO4 + H2O + CO2 2. FeCl3 Fe(OH)3 Fe2O3 Fe FeCl2 FeCl3 + 3NaOH Fe(OH)3 + 3NaCl t0 Fe(OH)3 2Fe2O3 + 3H2O t0 Fe2O3 + 3CO 2Fe + 3CO2 Fe + 2HCl FeCl2 + H2 3.PP 1: điện phân dung dịch NaCl bão hoà dp 2NaCl(dd bão hoà) + 2H2O Mn 2NaOH + H2 + Cl2 PP 2: Điều chế clo theo sơ đồ NaCl HCl Cl2 NaCl + H2SO4 HCl + Na2SO4 t0 4 HCl + MnO2 MnCl2 + Cl2 + 2H2O GV: nhận xét sửa. - Gv: Hướng dẫn làm bài tập 4, 5 Hs: giải bài tập theo nhóm đại diện - GV: Ghi nội dung bài tập lên bảng. lên sửa, - Y/c HS ghi gt/kl Hs nhóm khác nhận xét. - Gv: nhận xét . => Kết luận. Hoa 9-HK2- Theo PPCTmôùi: Trang : 2 2. Kiểm tra bài cũ: Kết hợp trong tiết (1 phút ) 3. Bài mới Hoạt động Thầy Hoạt động của trò Hoạt động 1: (44 phút) Kiến thức cần nhớ PHẦN II. HOÁ HỮU CƠ I. KIẾN THỨC CẦN NHỚ Gv: cho Hs lên viết Công thức 1. Công thức cấu tạo cấu tạo vào bảng phụ sau 2Hs:lên điền vào bảng ; 2Hs nhận xét Công Công Công Tên chất Tên chất thức thức cấu thức phân Công thức cấu tạo hữu cơ hữu cơ phân tử tạo tử H Metan Metan CH4 H C H Etilen H CH2 = CH2 Etilen C2H4 Axetilen Axetilen C H 2 2 CHCH Benzen Benzen C H Rượu 6 6 etylic Rượu C H O CH -CH -OH etylic 2 6 3 2 Axit axetic Axit C H O CH –COOH Gv: nhận xét, củngcố axetic 2 4 2 3 ? Viết PTHH phản ứng cháy của 2. Các phản ứng quan trọng hiđrocacbon,rượu etylic. a. Phản ứng cháy của hiđrocacbon,rượu etylic. Hs: lên bảng viết ; Hs khác nhận xét. t0 CH4 + 2O2 CO2 + 2H2O t0 C2H4 + 3O2 CO2 + 2H2O t0 C2H2 + O2 CO2 + 2H2O t0 Gv: nhận xét . 2C6H6 + 15O2 12CO2 + 6H2O t0 C2H6O + 3O2 2CO2 + 3H2O Gv: cho Hs viết PTHH phản ứng b. Phản ứng thế củametan, benzen với clo, brom thế. Hs: viết PTHH Gv: Nhận xét. Hs khác nhận xét as Gv:Ứng dụng của hiđro CH4 + Cl2 CH3Cl + HCl Fe cacbon C6H6 + Br2 C6H5-Br + HBr Gv: nhận xét . 3. Các ứng dụng ? Nêu ứng dụng của chất béo, a. Ứng dụng của hiđrocacbon Hoa 9-HK2- Theo PPCTmôùi: Trang : 4 0 H2SO4 ,dd ,t CH3COOH + C2H5OH CH3COOC2H5 + H2O Axit CH3COOC2H5 + H2O CH3COOH + C2H5OH Gv: hướng dẫn làm bài tập 5, 6 5. a. Dùng nước vôi trong, nhận CO2 hiện tượng. Dùng dung dịch brom nhận C2H4 hiện tượngcòn lại b. Dùng Na2CO3 nhận ra CH3COOH hiện tượng. Dùng Na nhận ra C2H5OH hiện tượng còn lại . c. Dùng Na2CO3 nhận ra CH3COOH hiện tượng. Dùng AgNO3 trong NH3 nhận glucozơ hiện tượng. Còn lại là Viết PTHH minh hoạ. 6,6.12 2,7.2 6. mC = = 1,8g ; mH = = 0,3g => mO = 5,5 - 0,3 - 1,8 = 2,4g 44 18 Gọi CTPT là CxHyOz Ta có 12x = y =16z = 60 Giải PT ta được x = 2 ; y = 4 ; z = 2 ; 1,8 0,3 2,4 45 => Công thức C2H4O2 4. Củng cố: (3 phút ) Tổng kết phần hữu cơ. 5. Hướng dẫn (2 phút ) Về nhà học bài xem bài tập chuẩn bị bài tốt để thi học kì II IV. RÚT KINH NGHIỆM ---------------------------------------------------------------------------------------------------------------- - Ưu: ---------------------------------------------------------------------------------------------------------------- - Nhược: ------------------------------------------------------------------------------------------------ KÝ DUYỆN TUẦN 36 Hoa 9-HK2- Theo PPCTmôùi: Trang : 6
File đính kèm:
 giao_an_hoa_hoc_lop_9_hoc_ki_ii_bai_56_on_tap_cuoi_nam_nam_h.doc
giao_an_hoa_hoc_lop_9_hoc_ki_ii_bai_56_on_tap_cuoi_nam_nam_h.doc