Giáo án Hóa học Lớp 9 - Học kì II - Bài 40 đến 42 - Năm học 2017-2018 - Nguyễn Đình Quyết
Bạn đang xem tài liệu "Giáo án Hóa học Lớp 9 - Học kì II - Bài 40 đến 42 - Năm học 2017-2018 - Nguyễn Đình Quyết", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Giáo án Hóa học Lớp 9 - Học kì II - Bài 40 đến 42 - Năm học 2017-2018 - Nguyễn Đình Quyết
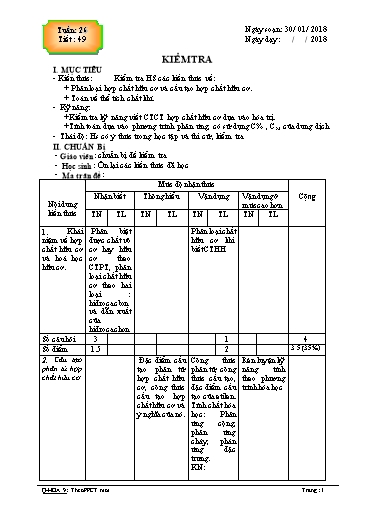
Số câu hỏi 1 2 1 3 6.5 (65%) Số điểm 2 3 1.5 3 1 3 1 8 Tổng số câu Tổng số 1.5 2 5 1.5 10 điểm (15%) (20%) (50%) (15%) (100%) III. CÁC BƯỚC LÊN LỚP 1. Ổn định lớp: ( 1 phút ) Kiểm tra sĩ số tác phong HS . 2. Phát đề kiểm tra: ĐỀ ĐỀ XUẤT A. PHẦN TRẮC NGHIỆM: (4điểm) Em hãy khoanh tròn vào A,B,C hoặc D cho câu trả lời đúng. Câu 1: Những hidrocacbon nào sau đây chỉ có liên kết đơn và liên kết đôi xen kẻ: A. Mêtan B. Etilen C. Axetilen D. Benzen Câu 2: Những hidrocacbon nào sau đây chỉ có liên kết đơn: A. Metan B. Etilen C. Axetilen D. Benzen Câu 3: Hợp chất hữu cơ là: A. Hợp chất của oxi với một nguyên tố hóa học khác B. Đơn chất của cacbon và hidro. C. Hợp chất của cacbon và hidro D. Hợp chất của cacbon (trừ CO, CO2, H2CO3 các muối cacbonat, các muối cacbua) Câu 4: Metan có nhiều ở: A. Mỏ khí B. Nước ao C. Không khí D. Nước biển Câu 5: Tính chất hóa học đặc trưng của benzen là: A. Phản ứng thế B. Phản ứng thế và phản ứng cộng. C. Phản ứng cộng và trùng hợp D. a, b, c đều đúng. Câu 6: Dãy hợp chất nào sau hoàn toàn là hợp chất hữu cơ: A. C2H4 , C2H6O , NaHCO3 ; B. CH3NO2 , C2H5OH, C2H3O2Na; C. C6H6 , CO2 , C2H2 , CH4 ; D. CH3COOH , CH3Cl , Na2CO3 ; Câu 7: Tính chất hóa học đặc trưng của metan là: A. Phản ứng thế B. Phản ứng cháy C. Phản ứng cộng D. Phản ứng trùng hợp Câu 8: Những hidrocacbon nào sau đây có liên kết ba: A. Metan B. Etilen C. Axetilen D. Benzen II. PHẤN TỰ LUẬN: (6 điểm) Câu 1: (2 điểm) Trình bày cách nhận biết 3 khí: CH4; C2H4 và CO2 đựng trong các lọ mất nhản. Câu 2: (4 điểm) Đốt cháy 4,48 lít khí C2H4 cần phải dùng. a) Bao nhiêu lít khí oxi ? b) Dẫn toàn bộ khí CO2 đốt cháy trên lội qua dung dịch nước vôi trong thì có bao nhiêu gam kết tủa. Các thể tích khí đo ở đktc ? ( Biết C = 12; H = 1; O = 16; Ca = 40) 3. Hướng dẫn chấm Q-HOA 9: Theo PPCT moi Trang : 2 Ngày soạn: 30 / 01 / 2018 Tuần: 26 Ngày dạy: Tiết : 50 Bài 41: DẦU MỎ VÀ KHÍ THIÊN NHIÊN I. MỤC TIÊU 1. Kiến thức - Nắm được tính chất vật lý, trạng thái tự nhiên, thành phần, cách khai thác và chế biến cũng như ứng dụng của dầu mỏ, khí thiên nhiên. - Biết crackinh là một phương pháp quan trọng để chế biến dầu mỏ . - Nắm được đặc điểm cơ bản của dầu mỏ Việt Nam, vị trí một số mỏ dầu, mỏ khí và tình hình khai thác dầu khí ở nước ta. 2. Kỹ năng Bảo quản phòng tránh cháy, nổ, ô nhiễm môi trường khi sử dụng dầu khí 3. Thái độ: Có ý thức trong bảo vệ môi trường II. CHUẨN BỊ: - GV: Dầu mỏ, tranh vẽ sơ đồ chưng cất dầu mỏ và ứng dụng của các sản phẩm thu được từ chế biến dầu mỏ , máy chiếu... - HS: Nghiên cứu trước bài học. III. CÁC BƯỚC LÊN LỚP 1. Ổn định lớp: Kiểm tra sĩ số, tác phong. (1 phút) 2. Kiểm tra bài cũ: Không 3. Bài mới: Hoạt động của GV và HS Nội dung, kiến thức Hoạt động1: (20 phút)Tìm hiểu về dầu mỏ - Cho HS quan sát mẫu dầu mỏ. I. DẦU MỎ - Y/c HS nhận xét. 1. Tính chất vật lý + Dầu mỏ có những tính chất vật lí nào ? Dầu mỏ là chất lỏng sánh, màu nâu đen, + Dầu mỏ có ở đâu: trên mặt trái đất, không tan trong nước và nhẹ hơn nước. trong lòng đất, trong biển hay dưới đáy 2. Trạng thái tự nhiên, thành phần biển ? dầu mỏ - HS quan sát, *Dầu mỏ có trong lòng đất gồm 3 lớp: - Trả lời. - Lớp khí ở trên gọi là lớp đồng hành - HS khác nhận xét và kết luận. hay khí mỏ dầu chủ yếu là metan . - Treo tranh H 4.16 - Lớp dầu mỏng có hòa tan khí ở giữa, là + Người ta khai thác bằng cách nào ? một hổn hợp phức tạp của nhiều - HS quan sát, hiđrocacbon và hợp chất khác. - Dưới đáy mỏ dầu là một lớp nước mặn - HS trả lời theo hướng dẫn của GV *Khai thác dầu mỏ người ta khoan Mô tả quá trình chưng cất dầu mỏ ? những giếng dầu. Các sản phẩm thu được khi chưng cất dầu 3. Các sản phẩm chế biến từ dầu mỏ mỏ ? xăng, metan, etylen ..... do số lượng GV bổ sung một số kết luận và cách khai xăng rất ít khi chưng cất dầu mỏ nên thác dầu mỏ . người ta thường sử dụng phương pháp -Treo tranh H 4.17 Crackinh để biến dầu nặng (diezen) - Y/c HS nhận xét. thành xăng . Dầu năng C r a c k i n h xăng + HH khí Q-HOA 9: Theo PPCT moi Trang : 4 --------------------------------------------------------------------- Tuần: 27 Ngày soạn: 06 / 01 / 2018 Tiết : 51 Ngày dạy: Bài 41 : NHIÊN LIỆU I. MỤC TIÊU 1. Kiến thức Nắm được nhiên liệu là những chất cháy được, khi cháy tỏa nhiệt và phát sáng. Nắm được cách phân loại nhiên liệu, đặc điểm, ứng dụng của một số nhiên liệu thông dụng. 2. Kỹ năng Nắm được cách sử dụng hiệu quả nhiên liệu. 3. Thái độ Có ý thức trong bảo vệ môi trường và tiết kiệm nhiên liệu II. CHUẨN Bị - GV: Biểu đồ hàm lượng cacbon trong than, năng suất toả nhệt của các nhiên liệu. - HS: Nghiên cứu trước bài học. III. CÁC BƯỚC LÊN LỚP 1. Ổn định lớp Kiểm tra sĩ số, tác phong. 2. Kiểm tra bài cũ (5 phút ) - Dầu mỏ là gì. Chế biến dầu mỏ như thế nào ? - Sản phẩm chế biến gồm những loại nào ? - Thành phần chủ yếu của khí thiên nhiên ứng dụng của nó ? 3. Bài mới Hoạt động của GV và HS Nội dung, kiến thức Hoạt động2: (20 phút) Tìm hiểu về phân loại nhiên liệu - GV: Đề nghị học sinh kể một số nhiên I . NHIÊN LIỆU LÀ GÌ ? liệu sử dụng hàng ngày. Nhiên liệu là những chất cháy được, khi - Cho HS nhận xét để rút ra đặc điểm cháy toả nhiệt và phát sáng. chung của các loại nhiên liệu. VD: than, củi, khí gaz, - HS: Trả lời theo hướng dẫn của GV Nhiên liệu có vai trò quan trọng trong đời =>Rút ra kết luận về nhiên liệu. sống và sản xuất Hoạt động2: (20 phút) Tìm hiểu về phân loại nhiên liệu - GV: Giới thiệu cơ sở phân loại nhiên liệu là II. PHÂN LOẠI NHIÊN LIỆU dựa vào trạng thái, yêu cầu HS sắp xếp và Có 3 loại phân loại các nhiên liệu đã nêu. a. Nhiên liệu rắn: - Sử dụng H4.22-H4.22 để HS nhận xét hoặc Than , gỗ, . so sánh b. Nhiên liệu lỏng : - HS: Thảo luận theo nhóm. Sản phẩm từ dầu mỏ (xăng, dầu, phân tích biểu đồ hàm lượng Cacbon trong .) và rượu than và năng suất tỏa nhiệt của các nhiên liệu c. Nhiên liệu khí : - KL: Nhiên liệu nào khi cháy tỏa nhiều nhiệt Khí thiên nhiên, khí mỏ dầu, khí lò và ít gây ô nhiểm mt ? cốc, khí than. Hoạt động1: (10 phút) Tìm hiểu cách sử dụng nhiên liệu - GV: Yêu cầu HS trình bày cách III. CÁCH SỬ DỤNG NHIÊN LIỆU HIỆU sử dụng nhiên liệu trong thực tế. QUẢ Q-HOA 9: Theo PPCT moi Trang : 6 - Nhận xét. Hoạt động2: (25 phút ) Hướng dẫn giải bài tập - Cho nhóm 1 lên làm bài tập số 1. GV II. BÀI TẬP nhận xét bổ sung và thông báo cho HS * Bài tập 1 trang 133/SGK biết tên các chất. a. C3H8 : CH3 – CH2 – CH3 propan - HS : Thảo luận theo nhón, giải bài tập b. C3H6 : có hai công thức cấu tạo : theo sự phân công CH3 – CH = CH2 propen - Cử đại diện lên trình bày. CH2 - Nhóm khác nhận xét => Hoàn thành bài tập CH2 CH2 Xiclopropan c. C3H4 có công thức cấu tạo - Cho nhóm 2 lên làm bài tập số 2 CH3 – C CH propin - HS : Thảo luận theo nhón, giải bài tập CH2 = CH = CH2 propadien theo sự phân công CH2 - Cử đại diện lên trình bày. - Nhóm khác nhận xét CH = CH xiclopropen => Hoàn thành bài tập * Bài tập 2 trang 133/SGK Dẫn hai khí lần lượt qua dd brom khí nào làm mất màu dd brom là C2H4, khí còn lại là CH4 C2H4 + Br2 C2H4Br2 - Cho nhóm 3 lên làm bài tập 3. * Bài tập 3 trang 133/SGK - GV: Gợi ý để giúp nhóm 3 Số mol Brom: 0,1 x 0,1 = 0,01(mol) Cho chất nào tác dụng được với dd nX 0,01 1 X là C2H4 brom. n 0,01 1 Br2 CH2=CH2 + Br2 Br CH2 CH2Br Viết phương trình, lập tỉ lệ => chất phản 0,01mol 0,01mol ứng. * Bài tập 4 trang 133/SGK - Hướng dẫn làm bài tập 4 12 2 m x8,8 2,4(g);m x5,4 0,6(g) a. Tính số mol H2O CO2 suy ra số mol c 44 H 18 H , C mC + mH = 2,4 + 0,6 = 3 (g) Tính số gam C, H cộng lại nếu đủ 3 gam a. Trong A chỉ có C và H không có oxi, chưa đủ có oxi. b. CT chung: CxHy b. Số mol H, C là x, y 2,4 0.6 x : y = : = 0,2 : 0,6=1 : 3 (CxHy)n = 40 tìm n 12 1 c. Nếu có liên kết đôi, ba làm mất màu Công thức nguyên (CH3)n d. Viết PTHH phản ứng thế (12+ 1.3)n< 40 15n < 40 - HS: Nghe, làm vào giấy nháp Nếu n=1 vô lí không đảm bảo hoá trị C - GV: Kiểm tra, nhận xét n = 2 ; MA = 30 < 40 Công thức A : C2H6 n =3 ; MA= 60 > 40 A : C2H6 d.PTHH As C2H6 + Cl2 C2H5 Cl + HCl Q-HOA 9: Theo PPCT moi Trang : 8
File đính kèm:
 giao_an_hoa_hoc_lop_9_hoc_ki_ii_bai_40_den_42_nam_hoc_2017_2.doc
giao_an_hoa_hoc_lop_9_hoc_ki_ii_bai_40_den_42_nam_hoc_2017_2.doc