Giáo án Hóa học Lớp 8 - Học kì II - Bài 40 đến 42 - Năm học 2017-2018 - Trường THCS Minh Diệu
Bạn đang xem tài liệu "Giáo án Hóa học Lớp 8 - Học kì II - Bài 40 đến 42 - Năm học 2017-2018 - Trường THCS Minh Diệu", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Giáo án Hóa học Lớp 8 - Học kì II - Bài 40 đến 42 - Năm học 2017-2018 - Trường THCS Minh Diệu
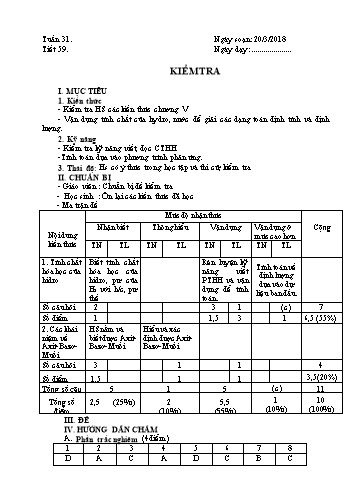
B. Phần tự luận: (6đ) Câu 1: (2đ) to 2H2 + O2 2 H2O (0,5đ) to C + 2H2 CH4 (0,5đ) to 3H2 + Fe2O3 2Fe + 3H2O (0,5đ) to H2 + CuO Cu + H2O (0,5đ) Câu 2: (1đ) - Nhúng giấy quỳ tím vào 3 dung dịch HCl; KOH; KCl, - Nếu dung dịch nào làm cho quỳ tím chuyển sang màu đỏ là lọ đựng HCl - Nếu dung dịch nào làm cho quỳ tím chuyển sang màu xanh là lọ đựng KOH - Nếu dung dịch nào làm cho quỳ tím không chuyển màu là lọ đựng KCl Câu 3: (4đ) Số mol Al =5,4 = 0,2 (mol) (0,5đ) 27 Phương trình hoá học: 2Al + 6HCl 2AlCl3 + 3H2 (0,5đ) 2mol 2mol 3mol 0,2mol ?mol ?mol 0,2.3 - Thể tích H2 thu được là: .22,4 = 6,72 (lít). (0,5đ) 2 - Khối lượng muối tạo thành: 0,2 . 133,5 = 26,7 g (0,5đ) to PTHH: 2H2 + O2 2H2O (0,5đ) 6,72 - Số mol của H2 = = 0,3 mol (0,25đ) 22,4 - Khối lượng nước tạo thành : 0,3 . 18 = 5,4 gam (0,25đ) V. THỐNG KÊ 9-10 7-8 5-6 3-4 1-2 Lớp Sĩ số SL % SL % SL % SL % SL % 8C 8D VI. RÚT KINH NGHIỆM ------------------------------------------------------------------------------------------------------ ------------------------------------------------------------------------------------------------------ ------------------------------------------------------------------------------------------------------ ------------------------------------------------------------------------------------------------------ ------------------------------------------------------------------------------------------------------ - GV: Vậy em hiểu như thế nào là dung môi; - Nước đường. chất tan và dung dịch? Hãy lấy VD về dung dịch + Dung môi: nước. và chỉ rõ chất tan, dung môi trong dung dịch đó? + Chất tan: đường =>HS: Trả lời, rút ra kết luận Hoạt động2: (12 phút) Tìm hiểu dung dịch bão hoà và dung dịch chưa bão hoà - GV: Hướng dẫn HS làm thí nghiệm 3. 2. Dung dịch bão hoà và dung dịch - Giúp HS rút Ra kết luận: Khi dung dịch chưa bão hoà. vẫn còn có thể hoà tan được thêm chất tan => gọi là dung dịch chưa bão hoà. - Dung dịch không thể hào tan thêm được chất tan => dung dịch bão hoà. - Ở một t0 xác định: - Vậy thế nào là dung dịch bão hoà và dung - Dung dịch chưa bão hoà là dung dịch chưa bão hoà? dịch có thể hoà tan thêm chất tan. -Yêu cầu các nhóm trình bày và nhận xét. - Dung dịch bão hoà là dung dịch => HS: Làm TN, rút ra kết luận không thể hoà tan thêm chất tan. Hoạt động3: (13 phút) Tìm hiểu làm thế nào để quá trình hoà tan chất rắn trong nước. - Hướng dẫn HS làm thí nghiệm: 3. Làm thế nào để quá - Yêu cầu các nhóm ghi lại kết quả => trình bày. trình hoà tan chất rắn - HS làm thí nghiệm: cho vào mỗi cốc (25 ml nước) trong nước một lượng muối ăn như nhau. + Cốc I: để yên; Cốc II: khuấy đều. + Cốc III: đun nóng; Cốc IV: nghiền nhỏ. - Muốn quá trình hoà tan - Yêu cầu các nhóm ghi lại kết quả => trình bày. chất rắn xảy ra nhanh hơn, - Vậy muốn quá trình hoà tan chất rắn trong nước thực hiện 1, 2 hoặc cả 3 được nhanh hơn ta nên thực hiện những biện pháp biện pháp sau: nào? - Khuấy dung dịch. - Yêu cầu các nhóm đọc SGK trả lời. - Đun nóng dung dịch. ? Vì sao khi khuấy dung dịch quá trình hoà tan chất - Nghiền nhỏ chất rắn. rắn nhanh hơn. ? Vì sai khi đun nóng, quá trình hoà tan nhanh hơn. ? Vì sao khi nghiền nhỏ chất rắn => tan nhanh. - HS Trả lời, rút ra kết luận 4. Củng cố (3 phút) Yêu cầu HS nhắc lại nội dung chính: Dung dịch là gì ? Dung dịch bão hoà và dung dịch chưa bão hoà? 5. Hướng dẫn về nhà (2 phút) Làm bài tập 5 SGK/138. IV. RÚT KINH NGHIỆM ---------------------------------------------------------------------------------------------------------------- - Ưu: ---------------------------------------------------------------------------------------------------------------- - Nhược: ---------------------------------------------------------------------------------------------------- ? Qua các hiện tượng thí nghiệm trên em rút ra kết luận gì (vế chất tan và chất không tan). - Tính tan của axit, bazơ ? a) Axit: Hầu hết axit tan được ? Những muối của kim loại nào, gốc axit nào đều trong nước. tan hết trong nước. ? Những muối nào phần lớn đều không tan trong b) Bazơ: Phần lớn bazơ không nước. tan trong nước. => Yêu cầu HS trình bày kết quả của nhóm. - Yêu cầu mỗi HS quan sát bảng tính tan viết c) Muối: Na, K và gốc NO 3 CTHH của: đều tan. a) 2 axit tan & 1 axit không tan. b) 2 bazơ tan & 2 bazơ không tan. + Phần lớn muối gốc Cl, c) 3 muối tan, 2 muối không tan. =SO4 tan. - HS: Thực hiện và trả lời các câu hỏi của GV + Phần lớn muối gốc =CO3, PO4 không tan. Hoạt động2: (20 phút) Tìm hiểu độ tan của một chất trong nước - Gv: Thông báo, để biểu thị khối lượng chất II. Độ tan của một chất trong tan trong một k/g dung môi => “độ tan”. nước. - Yêu cầu HS đọc SGK + độ tan kí hiệu là gì? + 1. Định nghĩa: Độ tan (S) của một ý nghĩa? chất là số gam chất đó tan được -Vd : ở 250C: độ tan của: trong 100g nước để tạo thành dung + Đường là: 240g. dịch bão hoà ở 1 t0 xác định. + Muối ăn lá: 36g. m * S = ct .100 => Ý nghĩa. m H 2O ? Độ tan của một chất phụ thuốc vào yếu tố nào. 2. Những yếu tố ảnh hưởng đến ? Yêu cầu HS quan sát hình 65 => nhận xét. độ tan 0 ? Theo em Skhí tăng hay giảm khi t tăng. a) Độ tan của chất rắn tăng khi 0 - Độ tan (khí): t & P. nhiệt độ tăng. - Yêu cầu HS lấy vd: b) Độ tan của chất khí tăng khi t0 giảm và P tăng. 4. Củng cố (2 phút) Yêu cầu HS đọc phần ghi nhớ 5. Hướng dẫn về nhà (4 phút) Làm bài tập 5/142. o Ở nhiệt độ 18 C, 250g nước hoà tan được 53g Na2CO3 để tạo dung dịch bão hoà. Vậy ở nhiệt độ 18 oC, 100g nước hoà tan được x(g) => x = 53.100 : 250 = 21,2 g Na2CO3 IV. RÚT KINH NGHIỆM ---------------------------------------------------------------------------------------------------------------- - Ưu: ---------------------------------------------------------------------------------------------------------------- - Nhược: ---------------------------------------------------------------------------------------------------------------- - GV: Hướng dẫn = 10 + 40 = 50g. + Theo đề bài đường gọi là gì, nước gọi là gì ? => C%= 10 x 100% = 20% + Khối lượng chất tan là bao nhiêu? 50 + Khối lượng dd là bao nhiêu? + Áp dụng? BT2: Tính khối lượng NaOH có - Yêu cầu HS làm bài tập 2. trong 200g dd NaOH 15%. BT2:Tính khối lượng NaOH có trong 200g dd Giải: NaOH 15%. Từ C% = mct . 100% - HS : Hoạt động giấy nháp. mdd + Trao đổi, thảo luận. C%.mdd => mct = + Xung phong lên giải. 100 + Nhận xét, bổ sung nếu có. 15.200 => mNaOH = = 30g 100 - Hướng dẫn + Đề bài cho ta biết gì? Yêu cầu ta làm gì ? + Khối lượng chất tan là khối lượng của chất nào ? - Khuyến khích HS lên bảng - So sánh đề bài tập 1 và 2 tìm đặc điểm khác BT3: Hoà tan 20g muối vào nước nhau. được dd có nồng độ là 10%. BT3: a) Tính mdd nước muối . Hoà tan 20g muối vào nước được dd có nồng b) Tính mnước cần. độ là 10%. Giải: a) mct = mmuối = 20g. a) Tính mdd nước muối b) Tính mnước cần. C% = 10%. - GV: Hướng dẫn làm bài tập 3 mct ? Muốn tính được m dd của một chất khi biết m ct Biểu thức: C% = . 100% và C% ta phải làm cách nào? mdd mct => Dựa vào biểu thức nào ta có thể tính được => mdd = . 100% C% mdm. - HS. = 20 . 100% = 200g + Trao đổi, thảo luận. 10 + Xung phong lên giải. b) Ta có: m = m + m => Nhận xét, bổ sung nếu có. dd ct dm - GV: Khuyến khích HS lên bảng, có thể cho mdm= mdd – mct điểm, nếu làm đúng. = 200 – 20 = 180g 4. Củng cố (1phút) Nêu lại công thức tính và cách áp dụng 5. Hướng dẫnvề nhà (4 phút) - BT1/145: Trước hết, tìm khối lượng chất tan BaCl2 có trong 200 g dung dịch 5%. 5.200 m 10 (g) BaCl2 100 Như vậy câu trả lời đúng là (B). BT7/145:
File đính kèm:
 giao_an_hoa_hoc_lop_8_hoc_ki_ii_bai_40_den_42_nam_hoc_2017_2.doc
giao_an_hoa_hoc_lop_8_hoc_ki_ii_bai_40_den_42_nam_hoc_2017_2.doc