Đề cương ôn tập môn Hóa học Lớp 9 - Học kì I - Trường THCS Hòa Bình
Bạn đang xem tài liệu "Đề cương ôn tập môn Hóa học Lớp 9 - Học kì I - Trường THCS Hòa Bình", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề cương ôn tập môn Hóa học Lớp 9 - Học kì I - Trường THCS Hòa Bình
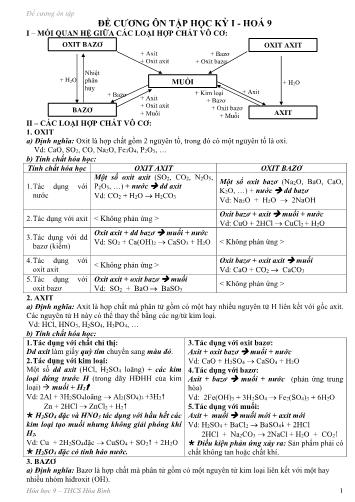
Đề cương ôn tập Vd: KOH, NaOH, Ba(OH)2, Al(OH)3, b) Tính chất hóa học: 1. Tác dụng với chất chỉ thị: Dd bazơ làm giấy 4. Tác dụng với muối: quỳ tím chuyển sang màu xanh, dd Dd bazơ + dd muối muối mới + bazơ mới phenolphtalein chuyển sang màu đỏ. Vd: Ba(OH)2 + CuSO4 BaSO4 + Cu(OH)2 2. Tác dụng với oxit axit: 3NaOH + FeCl3 Fe(OH)3 + 3NaCl Dd bazơ + oxit axit muối + nước Điều kiện phản ứng xảy ra: Sản phẩm phải có Vd: Ca(OH)2 + SO3 CaSO4 + H2O chất không tan. 3. Tác dụng với axit: 5. Phản ứng nhiệt phân: 0 Bazơ + axit muối + nước (phản ứng trung Bazơ không tan t oxit bazơ + nước 0 hòa) t Vd: Cu(OH)2 CuO + H2O Vd: NaOH + HCl NaCl + H2O 4. MUỐI a) Định nghĩa: Muối là hợp chất mà phân tử có một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit. Vd: NaCl, MgSO4, Fe(NO3)2, BaCO3, b) Tính chất hóa học: 1. Tác dụng với kim loại: 3. Tác dụng với bazơ: Muối + kim loại muối mới + kim loại mới Dd muối + dd bazơ muối mới + bazơ mới Vd: Fe + CuSO4 FeSO4 + Cu Vd: CuSO4 + 2NaOH Cu(OH)2 + Na2SO4 Cu + 2AgNO3 Cu(NO3)2 + 2Ag Điều kiện phản ứng xảy ra: Sản phẩm phải có Lưu ý: Kim loại đứng trước (trừ K, Na, Ca, chất không tan. ) đẩy kim loại đứng sau (trong dãy HĐHH của 4. Tác dụng với muối: kim loại) ra khỏi dung dịch muối của chúng. Muối + muối 2 muối mới 2. Tác dụng với axit: Vd: NaCl + AgNO3 AgCl + NaNO3 Muối + axit muối mới + axit mới Điều kiện phản ứng xảy ra: Sản phẩm phải có Vd: BaCl2 + H2SO4 BaSO4 + 2HCl chất không tan. Na2CO3 + 2HCl 2NaCl + H2O + CO2 5. Phản ứng nhiệt phân hủy: Điều kiện phản ứng xảy ra: Sản phẩm phải có Một số muối bị phân hủy ở nhiệt độ cao: t0 chất không tan hoặc chất khí. Vd: CaCO3 CaO + CO2 c) Phản ứng trao đổi: - Định nghĩa: Là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới. Vd: BaCl2 + H2SO4 BaSO4 + 2HCl - Điều kiện để phản ứng trao đổi xảy ra: Phản ứng trao đổi trong dung dịch của các chất chỉ xảy ra nếu sản phẩm tạo thành có chất không tan hoặc chất khí. Lưu ý: Phản ứng trung hòa cũng là phản ứng trao đổi và luôn xảy ra. Vd: NaOH + HCl NaCl + H2O III – KIM LOẠI: 1. Tác dụng với phi kim: Thường ở nhiệt độ cao. 3. Tác dụng với nước: Với khí oxi: Tạo oxit. Một số kim loại (Na, K, ...) + nước dd kiềm + t0 Vd: 3Fe + 2O 2 Fe3O4 H2 Với các phi kim khác (Cl2, S, ): Tạo muối. Vd: 2Na +2H2O 2NaOH + H2 t0 t0 Vd: 2Na + Cl 2 2NaCl ; Fe + S FeS 4. Tác dụng với muối: 2. Tác dụng với dd axit: Muối + kim loại muối mới + kim loại mới Kim loại đứng trước H (trong dãy HĐHH của Vd: Fe + CuSO4 FeSO4 + Cu kim loại) + dd axit (HCl, H2SO4 loãng) muối Cu + 2AgNO3 Cu(NO3)2 + 2Ag + H2 Lưu ý: Kim loại đứng trước (trừ K, Na, Ca, Vd: 2Al + 3H2SO4loãng Al2(SO4)3 +3H2 ) đẩy kim loại đứng sau (trong dãy HĐHH của kim loại) ra khỏi dung dịch muối của chúng. Hóa học 9 – THCS Hòa Bình 2 Đề cương ôn tập A. BaCl2,H2SO4. B. BaCl2, Na2SO4. C. KCl, NaNO3. D. AgNO3, KCl. Câu 11: Nếu chỉ dùng dung dịch NaOH thì có thể phân biệt được 2 dung dịch muối trong mỗi cặp chất sau A. Na2SO4 và Fe2(SO4)3. B. Na2SO4 và K2SO4. C. Na2SO4 và BaCl2. D. Na2CO3 và K3PO4. Câu 12: Có hai dung dic̣ h CuSO4 và Na2SO4, thuốc thử nào có thể dùng để phân biêṭ các dung dich:̣ A. Qùi tím B. Dung dicḥ axit HCl C. Dung dicḥ NaOH D. Dung dicḥ phenolphtalein . Câu 13: Điều kiêṇ để muối tác dung̣ với axit là: A. Không cần điều kiêṇ B. Muối mới không tan trong axit mới hoăc̣ axit taọ thành yếu hơn và dễ bay hơi hơn C. Muối mới và axit mới không tan D. Axit taọ thành yếu hơn và dễ bay hơi hơn Câu 14: Dãy phân bón hoá học chỉ chứa toàn phân bón đơn là A. (NH4)2SO4 , KCl , Ca(H2PO4)2. B. KCl , NH4H2PO4 , Ca(H2PO4)2. C. KNO3 , NH4NO3 , (NH2)2CO. D. (NH4)2SO4 ,KNO3 , NH4Cl Câu 15: Khi cho 500ml dung dịch NaOH 1M tác dụng hết với dung dịch H2SO4 2M tạo thành muối trung hòa. Thể tích dung dịch H2SO4 2M là: A. 250 ml. B. 400 ml. C. 500 ml. D. 125 ml Câu 16: Cho 21 gam MgCO3 tác dụng với một lượng vừa đủ dung dịch HCl 2M. Thể tích dung dịch HCl đã dùng là A. 2,5 lít B. 0,25 lít C.3,5 lít D. 1,5 lít PHẦN II: TỰ LUẬN 1. Dạng chuỗi phản ứng (1) (2) (3) (4) a) Na Na2O NaOH Na2CO3 NaCl b) Fe FeCl2 Fe(OH)2 FeO FeSO4 c) Ca CaO Ca(OH)2 CaCO3 Ca(HCO3)2 (2) (3) d) Al Al2(SO4)3 Al(OH)3 Al2O3 AlCl3 e) Fe2(SO4)3 Fe(OH)3 Fe2O3 FeCl3 Fe 2. Dạng bài nhận biết a) Chỉ được dùng dd HCl. Phân biệt 3 chất rắn CuO, Al2O3, Fe đựng trong 3 lọ riêng biệt b) Phân biêṭ các chất rắn: Na2O, Al2O3, Al. Điều kiêṇ chỉ đươc̣ dùng nước. c) Bằng phương pháp hoá học em hãy nhận biết được 4 lọ hoá chất mất nhãn đựng riêng biệt 4 chất rắn dạng bột: Fe, Fe2O3, CaO, P2O5. 3. Dạng bài tập Bài 1: Cho 2,7g Al vào bình chứa khí Cl2 (vừa đủ) sau khi phản ứng kết thúc thu được AlCl3. a) Tính khối lượng Cl2 đã phản ứng b) Để trung hoà hết 2,7g Al trên thì cần bao nhiêu ml dung dịch HCl 1M Bài 2: Cho kim loaị Fe vào 200 ml dung dicḥ H2SO4 loañ g, người ta thu được FeSO4 và 5,6 lit khi ́ H2 (đktc). a) Tính khối lương̣ của kim loaị Fe phản ứng. b) Tính nồng độ mol (CM) của dd H2SO4 đã dùng. Bài 3: Cho 1,6g đồng (II) oxit tác dung̣ với 100g dung dicḥ axit sunfuric có nồng đô ̣20%. a) Viết phương trình hóa hoc̣ b) Tính nồng đô ̣phần trăm của các chất có trong dung dicḥ sau khi phản ứ ng kết thúc. Hóa học 9 – THCS Hòa Bình 4 Đề cương ôn tập P/ứ thủy phân(tác Không phản ứng Không phản ứng dụng với nước) Phản ứng xà phòng hóa Điều chế a. (-C6H10O5-)n(tinh bột hoặc a. C2H5OH + O2 Men giấm CH3COOH o xenlulozơ) + H2O b.2C4H10 + 5O2 xt, t Men 4CH3COOH + 2H2O. 400 nC6H12O6 Men 2nC2H5OH +2nCO2. c.Chưng gỗ ( nồi kín) CH3COOH b. C2H4 + H2O C2H5OH b. Glucozơ, Saccarozơ, tinh bột và xenlulozơ. Glucozơ(C6H12O6) Saccarozơ(C12H22O11) Tinh bột và xenlulozơ Phản ứng oxi C6H12O6 + Ag2O NH3 Không phản ứng Không phản ứng hóa C6H12O7 + 2Ag. (axit gluconic) Phản ứng lên C6H12O6 Men rượu Không phản ứng Không phản ứng men 2C2H5OH + 2CO2 Phản ứng thủy Không phản ứng C12H22O11 + H2O (-C6H10O5-)n + nH2O 0 0 phân H2SO4, t C6H12O6 Axit, t nC6H12O6 ( glucozơ) + C6H12O6 (Fructozơ) Phản ứng với iot Không phản ứng Không phản ứng Hồ tinh bột + Nước iot (màu nâu) màu xanh thẫm Điều chế (-C6H10O5-)n + nH2O Từ mía Do sự quang tổng hợp trong 0 Axit, t nC6H12O6 cây xanh: 6nCO2 + 5nH2O clorophin, a’s’ (-C6H10O5-)n + 6nCO2 Hóa học 9 – THCS Hòa Bình 6 Đề cương ôn tập ( Biết Drượu = 0,8g/ml ; DH2O = 1g/ml ) c) Pha thêm 10,6 ml nước vào rượu 960 ở trên. Tính độ rượu thu được. ( Biết C = 12 , H = 1 , O = 16 ) 23. Cân bằng phương trình hóa học theo sơ đồ sau: CH4 C2H2 C2H4 C2H5OH CH3COOH CO2 24. Đốt cháy hoàn toàn 30ml rượu êtilic chưa rõ độ rượu rồi cho toàn bộ sản phẩm đi vào nước vôi trong (lấy dư). Lọc kết tủa, sấy khô cân nặng 100g. a). Tính thể tích không khí để đốt cháy rượu hoàn toàn. Biết thể tích oxi chiếm 1/5 thể tích không khí. b). Xác định độ rượu (biết khối lượng riêng rượu nguyên chất là 0,8g/ml) 25. Trình bày tính chất hoá học của: Metan, etylen, axetilen, benzen, rượu etilic, axit axetic. 26. Hãy nhận biết các khí sau bằng phương pháp hoá học: CO2 ,CH4 ,C2H4 .Viết các phương trình hoá học. 27. Hãy nhận biết các khí sau bằng phương pháp hoá học: CO2, CH4 , H2 ,C2H4. Viết các phương trình hoá học. 28. Hoàn thành dãy biến hoá sau (ghi điều kiện nếu có) a/ C2H4 C2H5OH CH3COOH (CH3COO)2 Zn CH3COOC2H5 CH3COONa natri axetat. b/ glucozơ Rượu etylic axit axetic etyl axetat. c/ C2H5OH C2H4 C2H5Cl C2H5OH HCl d/ FeCl3 Cl2 NaClO NaCl đ/ đá vôi (1) vôi sống (2) đất đèn (3) axetylen (6) etylen (7) P.E (4 ) (8 ) (5) PVC CH2=CHCl Rượu etylic 29. Cho 30g Axit axêtic tác dụng với 27,6g rượu etylic có H2SO4 đặc làm chất xúc tác, đun nóng thu được 35,2 g este (etyl axetat) a/ Viết phương trình hoá học của phản ứng ? b/ Tính hiệu suất của phản ứng este hoá ? 30. Khi cho 2,8 lít hỗn hợp etylen và mêtan đi qua bình đựng nước brom,thấy có 4 gam brom đã tham gia phản ứng.Tính thành phần phần trăm về thể tích các khí trong hỗn hợp,biết phản ứng xảy ra hoàn toàn và thể tích các khí đo ở điều kiện tiêu chuẩn. 31. Cho 5,6 lít (đktc) hỗn hợp khí metan và etylen đi qua nước brom dư thấy có 4 gam brôm tham gia phản ứng. a/ Viết phương trình hóa học. b/ Tính thành phần % về thể tích của mỗi khí trong hỗn hợp. 32. Cho 21,2 gam hỗn hợp gồm rượu etylic và axit axetic phản ứng với Na dư thì thu được 4,48 lít khí (đktc).Tính phần trăm khối lượng mỗi chất trong hỗn hợp 33. Cho 5.6 lít (đktc) hỗn hợp khí gồm C2H4 và C2H2 tác dụng hết với dung dịch brom dư, lượng brom đã tham gia phản ứng là 56 gam: a/ Hãy viết phương trình PƯHH b/ Tính phần trăm thể tích của mỗi khí trong hỗn hợp 34. Cho 500 ml dung dịch CH3 COOH tác dụng vừa đủ với 30 g dung dịch NaOH 20%. a/ Tính nồng độ mol/lít của dung dịch CH3COOH . Hóa học 9 – THCS Hòa Bình 8
File đính kèm:
 de_cuong_on_tap_mon_hoa_lop_9_hoc_ki_i_truong_thcs_hoa_binh.pdf
de_cuong_on_tap_mon_hoa_lop_9_hoc_ki_i_truong_thcs_hoa_binh.pdf